- 首页 > 正文
病例分享丨中年男子血尿、蛋白尿,合并恶性高血压!积极控制高血压对此类患者意义非凡
发表时间:2024-03-09 17:50:12
编者按
IgA肾病是最常见的原发性肾小球疾病,也是我国终末期肾病最常见的病因。IgA肾病同时也是引起肾实质性恶性高血压的主要原因之一,既往研究认为伴恶性高血压的IgA肾病患者临床病情和肾脏病变程度均比无恶性高血压的IgA肾病患者严重。恶性高血压是IgA肾病最为主要的临床表现,也是较重的表现类型。
01/临床资料
男性,33岁。
主诉:头痛1个月,水肿3周。
现病史:1个月前感冒后头痛,不伴头晕、视物旋转,无肢体活动障碍,2天后自觉视物模糊伴恶心、呕吐。3周前出现颜面水肿,外院查血压200/130 mmHg,尿蛋白(+++),潜血(+++),血肌酐298 μmol/L,血红蛋白(Hb)100 g/L,考虑急进性肾小球肾炎,予甲泼尼龙250 mg冲击,3天后改为静点甲泼尼龙40 mg/d,同时予阿替洛尔、硝苯地平控制血压,1周前出现双下肢水肿,为进一步诊治入院。发病以来自觉夜尿增多,无发热、皮疹、关节痛及光过敏。
既往史:体健。
入院查体:体温36.5 ℃,脉搏80次/分,呼吸16次/分,血压180/120 mmHg(双侧);双肺呼吸音清,未闻及干湿啰音。心律齐,腹软无压痛,双下肢中度水肿。
辅助检查:血常规:白细胞(WBC) 7.6×109/L,Hb 114 g/L,血小板(PLT)186×109/L;尿常规:潜血(+++),蛋白(+++),尿沉渣分析:20~40/HP,80%为变形红细胞。24小时尿蛋白定量4.45 g(尿量1600 ml);生化:血肌酐343 μmol/L,尿素氮14.7 mmol/L,血清白蛋白(ALB)36.2 g/L,乳酸脱氢酶(LDH)220 IU/L。乙肝表面抗原(HBsAg)(-),丙型肝炎病毒(HCV)-抗体(-);抗核抗体(ANA)谱(-),抗中性粒细胞胞胞浆抗体(ANCA)(-);血IgA、IgG、IgM及C3、C4水平均正常。
肾脏B超:右肾10.7 cm×4.6 cm×3.5 cm,实质厚1.6cm;左肾11.2 cm×4.8 cm×3.8 cm,实质厚1.6 cm。双肾被膜不光滑,实质回声增强,内部结构模糊。
肾动脉彩超:双肾动脉未见狭窄。
肾上腺彩超:双侧肾上腺未见明确占位。
超声心动图:各房室大小正常,射血分数(EF)68%。
眼底检查:可见双侧视网膜有线样出血,伴有视盘(乳头)水肿。
初步诊断:急性肾损伤;恶性高血压
02/诊断思路和临床诊治经过
该患者是青年男性,血尿,大量蛋白尿,血压显著升高,血肌酐水平升高,存在急性肾损伤。但该患者无既往查体资料,不能排除慢性肾功能不全的急性加重。
关于急性肾损伤的病因,该患者无明确肾前性及肾后性因素,可能的病因有:
①恶性高血压肾损害:该患者血压最高时舒张压大于130 mmHg,需高度怀疑此可能性。因此我们完善了眼底检查,眼底检查可见视网膜出血及视盘水肿,故恶性高血压可明确诊断,其肾损伤可待肾活检进一步证实。
②新月体性肾炎:该患者临床符合“急进性肾炎综合征”,但抗肾小球基底膜(CBM)抗体及ANCA阴性,因此不支持I型及Ⅲ型新月体肾炎。关于Ⅱ型新月体肾炎,患者无红斑狼疮、紫癜性肾炎等临床表现,且急进性肾小球肾炎一般血压升高幅度并不如此突出,根据此患者血压显著升高的特点,考虑新月体肾炎的可能性相对较小,但确诊仍需肾活检。
③肾小管间质病:该患者既往无特殊用药史,尿中大量红细胞及蛋白,不符合肾小管间质损伤特点。
④肾动脉狭窄:该患者高血压突出,应需考虑有无肾动脉狭窄引起的高血压,但该患者肾动脉彩超不支持此诊断。
基于以上分析,我们认为该患者恶性高血压导致急性肾损伤的可能性最大,肾实质性高血压是引起恶性高血压最常见的继发因素(我们也结合患者临床表现筛查了一些其他可引起恶性高血压的因素,如肾动脉、肾上腺超声),由于IgA肾病是最常见的原发性肾小球肾炎,因此肾实质性恶性高血压又以IgA肾病引起最为多见。该患者入院后停用糖皮质激素,予卡托普利50 mg/d、硝苯地平控释片60 mg/d、卡维地洛50 mg/d控制血压。为了明确诊断,我们在患者血压控制满意(140/90 mmHg左右)之后,进行了肾活检。
免疫荧光:IgA(+++),IgG(-),IgM(++),C3(++),C1q(-),肾小球内纤维蛋白相关抗原(FRA)(-),团块状、颗粒状系膜区沉积(图1)。
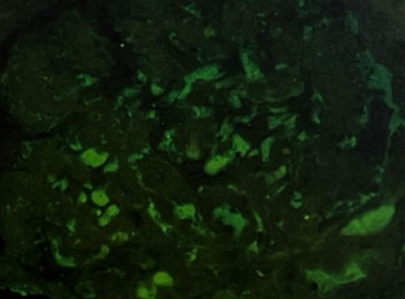
图1. 合并恶性高血压的IgA肾病:IgA沿肾小球系膜区团块状沉积(+++)(免疫荧光×400)
光镜:27个肾小球,其中22个缺血性硬化,其余肾小球系膜细胞和基质轻度弥漫增生,局灶节段性中度加重伴嗜复红蛋白沉积,节段性内皮细胞增生,基底膜缺血性皱缩,其中1个细胞性、2个小细胞纤维性新月体形成。肾小管萎缩,灶状代偿肥大。肾间质灶状淋巴及单核细胞浸润伴纤维化。小动脉管壁增厚,内膜葱皮样增生,管腔狭窄(图2)。诊断:系膜增生性IgA肾病伴恶性高血压肾损伤。
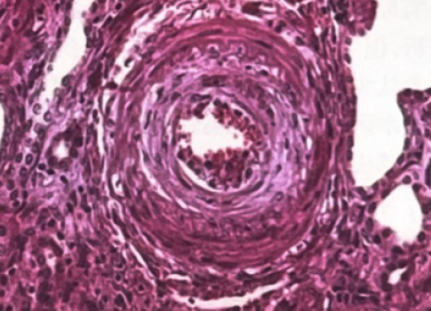
图2. 合并恶性高血压的IgA肾病:肾小球小叶间动脉管壁增厚,内膜葱皮状增生,管腔狭窄(HE×200)
结合临床及病理检查结果,患者IgA肾病继发恶性高血压肾损伤诊断明确,将短效血管紧张素转化酶抑制剂(ACEI)卡托普利改为长效依那普利30 mg/d,并继续予硝苯地平控释片60 mg/d、卡维地洛50 mg/d,血压控制在130/90 mmHg左右。关于原发肾小球疾病,患者肾小球缺血性硬化广泛,在肾活检标本中仅见5个未硬化的肾小球,其中1个细胞性、2个小细胞纤维性新月体,且在血压控制平稳后复查尿蛋白仍达3.1 g/d,血肌酐持续高,考虑有一定活动性病变。给予患者泼尼松40 mg/d、环磷酰胺50 mg/d。1个月后复查尿蛋白2.5 g/d,血肌酐390 μmol/L。泼尼松逐渐减量,6个月后停用。环磷酰胺4个月后停用(总量约6 g)。目前随访1年,监测血压130/80 mmHg左右,血钾水平正常范围,血肌酐350~400 μmol/L,尿蛋白1~2 g/d。
最终诊断:慢性肾小球肾炎(系膜增生性IgA肾病伴恶性高血压肾损伤);慢性肾脏病3期;肾性高血压
03/讨论
恶性高血压是一种高血压危象,中青年男性多见,常累及心、脑、肾等重要脏器。其诊断标准:①舒张压大于130 mmHg。②眼底检查可见视网膜水肿和火焰状出血、棉絮样渗出(Ⅲ级眼底病变)和(或)视盘水肿(Ⅳ级眼底病变)。恶性高血压可由原发或继发性高血压引起。继发性因素包括肾实质疾病、肾血管疾病、及内分泌疾病(如嗜铬细胞瘤、库欣综合征),其中肾实质疾病是最常见的原因之一,而IgA肾病是最常见的引起恶性高血压的肾实质疾病。合并恶性高血压的IgA肾病患者往往肾功能恶化迅速,如不及时控制血压,可很快进展至终末期肾脏病。
一些线索可帮助鉴别肾实质性恶性高血压和原发性恶性高血压:临床上,前者尿蛋白量较大(即使血压控制较平稳后),常可达肾病水平;后者尿蛋白量较少,在血压得到控制后平均1 g/d左右。前者多无家族史,而后者相反。病理上,前者小动脉洋葱皮样病变可不典型,肾小球病变弥漫、球性分布,有相应原发性肾小球病的特点(如在本例患者健存的肾小球中即可见到系膜弥漫增生,新月体形成,这符合IgA肾病病变多样的特点);后者小动脉常呈典型洋葱皮样病变,肾小球以急性缺血性病变为主,病变常为局灶、节段性分布。对于IgA肾病继发恶性高血压患者的研究发现:恶性高血压的血管病变与肾小球病变可以不平行,如轻度系膜增生性IgA肾病可伴发严重的血管病变和肾小管间质病变,应引起重视。
需要说明的是,恶性高血压属于血栓性微血管病的范畴,对于此类患者需要明确是否存在临床显性的血栓性微血管病。显微镜下破碎红细胞比例增高、网织红细胞计数升高、血小板减少及血乳酸脱氢酶升高提示可能存在机械性溶血,是支持血栓性微血管病的临床线索。此外,还需结合临床表现评价高血压的相关靶器官损害。
恶性高血压确诊后需积极降压治疗,以防止脑血管事件、急性肺水肿和肾衰竭等严重合并症的发生或进展。急性期可予静脉硝普钠静滴,长期控制血压以ACEI/血管紧张素受体激动剂(ARB)为基础,一般需两种或两种以上降压药物联合治疗。随着血压的降低肾小动脉纤维素样坏死的吸收,肾脏病理改变可以部分逆转,肾功能损害可能会终止或好转。部分进入透析的患者尚可脱离透析,但可能需观察数月。肾实质疾病继发恶性高血压者较原发恶性高血压者预后差。有学者认为血压是可干预的影响肾脏预后的危险因素。
本病例除降压治疗之外,还给予了激素和环磷酰胺的免疫抑制治疗。这是针对其原发肾小球疾病——IgA肾病的治疗,由于该患者活检标本健存的肾小球数量少,在仅有的5个健存肾小球中,仍能看到一些活动病变,考虑到IgA肾病病变不均匀的特点,不能排除其仍有较多活动病变,呈进展性;且患者较年轻,一般状态较好,可耐受免疫抑制治疗,因此,我们按照改善全球肾脏病预后组织(KDIGO)指南关于进展性IgA肾病的治疗建议,应用了激素和环磷酰胺。在临床上,使用激素和免疫抑制剂时,要结合个体情况,仔细权衡利弊,密切监测其可能带来的副作用。
参考文献
[1] Boulestreau R, et al. J Am Heart Assoc. 2022; 11(7): e023397.
[2] Lewek J, et al. Expert Opin Pharmacother. 2020;21(10):1189-1192.
[3] Haridasan S, et al. Indian J Nephrol. 2021;31(5):467-473.
[4] Jolobe O. Br J Hosp Med (Lond). 2015;76(3):177.
IgA肾病是最常见的原发性肾小球疾病,也是我国终末期肾病最常见的病因。IgA肾病同时也是引起肾实质性恶性高血压的主要原因之一,既往研究认为伴恶性高血压的IgA肾病患者临床病情和肾脏病变程度均比无恶性高血压的IgA肾病患者严重。恶性高血压是IgA肾病最为主要的临床表现,也是较重的表现类型。
01/临床资料
男性,33岁。
主诉:头痛1个月,水肿3周。
现病史:1个月前感冒后头痛,不伴头晕、视物旋转,无肢体活动障碍,2天后自觉视物模糊伴恶心、呕吐。3周前出现颜面水肿,外院查血压200/130 mmHg,尿蛋白(+++),潜血(+++),血肌酐298 μmol/L,血红蛋白(Hb)100 g/L,考虑急进性肾小球肾炎,予甲泼尼龙250 mg冲击,3天后改为静点甲泼尼龙40 mg/d,同时予阿替洛尔、硝苯地平控制血压,1周前出现双下肢水肿,为进一步诊治入院。发病以来自觉夜尿增多,无发热、皮疹、关节痛及光过敏。
既往史:体健。
入院查体:体温36.5 ℃,脉搏80次/分,呼吸16次/分,血压180/120 mmHg(双侧);双肺呼吸音清,未闻及干湿啰音。心律齐,腹软无压痛,双下肢中度水肿。
辅助检查:血常规:白细胞(WBC) 7.6×109/L,Hb 114 g/L,血小板(PLT)186×109/L;尿常规:潜血(+++),蛋白(+++),尿沉渣分析:20~40/HP,80%为变形红细胞。24小时尿蛋白定量4.45 g(尿量1600 ml);生化:血肌酐343 μmol/L,尿素氮14.7 mmol/L,血清白蛋白(ALB)36.2 g/L,乳酸脱氢酶(LDH)220 IU/L。乙肝表面抗原(HBsAg)(-),丙型肝炎病毒(HCV)-抗体(-);抗核抗体(ANA)谱(-),抗中性粒细胞胞胞浆抗体(ANCA)(-);血IgA、IgG、IgM及C3、C4水平均正常。
肾脏B超:右肾10.7 cm×4.6 cm×3.5 cm,实质厚1.6cm;左肾11.2 cm×4.8 cm×3.8 cm,实质厚1.6 cm。双肾被膜不光滑,实质回声增强,内部结构模糊。
肾动脉彩超:双肾动脉未见狭窄。
肾上腺彩超:双侧肾上腺未见明确占位。
超声心动图:各房室大小正常,射血分数(EF)68%。
眼底检查:可见双侧视网膜有线样出血,伴有视盘(乳头)水肿。
初步诊断:急性肾损伤;恶性高血压
02/诊断思路和临床诊治经过
该患者是青年男性,血尿,大量蛋白尿,血压显著升高,血肌酐水平升高,存在急性肾损伤。但该患者无既往查体资料,不能排除慢性肾功能不全的急性加重。
关于急性肾损伤的病因,该患者无明确肾前性及肾后性因素,可能的病因有:
①恶性高血压肾损害:该患者血压最高时舒张压大于130 mmHg,需高度怀疑此可能性。因此我们完善了眼底检查,眼底检查可见视网膜出血及视盘水肿,故恶性高血压可明确诊断,其肾损伤可待肾活检进一步证实。
②新月体性肾炎:该患者临床符合“急进性肾炎综合征”,但抗肾小球基底膜(CBM)抗体及ANCA阴性,因此不支持I型及Ⅲ型新月体肾炎。关于Ⅱ型新月体肾炎,患者无红斑狼疮、紫癜性肾炎等临床表现,且急进性肾小球肾炎一般血压升高幅度并不如此突出,根据此患者血压显著升高的特点,考虑新月体肾炎的可能性相对较小,但确诊仍需肾活检。
③肾小管间质病:该患者既往无特殊用药史,尿中大量红细胞及蛋白,不符合肾小管间质损伤特点。
④肾动脉狭窄:该患者高血压突出,应需考虑有无肾动脉狭窄引起的高血压,但该患者肾动脉彩超不支持此诊断。
基于以上分析,我们认为该患者恶性高血压导致急性肾损伤的可能性最大,肾实质性高血压是引起恶性高血压最常见的继发因素(我们也结合患者临床表现筛查了一些其他可引起恶性高血压的因素,如肾动脉、肾上腺超声),由于IgA肾病是最常见的原发性肾小球肾炎,因此肾实质性恶性高血压又以IgA肾病引起最为多见。该患者入院后停用糖皮质激素,予卡托普利50 mg/d、硝苯地平控释片60 mg/d、卡维地洛50 mg/d控制血压。为了明确诊断,我们在患者血压控制满意(140/90 mmHg左右)之后,进行了肾活检。
免疫荧光:IgA(+++),IgG(-),IgM(++),C3(++),C1q(-),肾小球内纤维蛋白相关抗原(FRA)(-),团块状、颗粒状系膜区沉积(图1)。

图1. 合并恶性高血压的IgA肾病:IgA沿肾小球系膜区团块状沉积(+++)(免疫荧光×400)
光镜:27个肾小球,其中22个缺血性硬化,其余肾小球系膜细胞和基质轻度弥漫增生,局灶节段性中度加重伴嗜复红蛋白沉积,节段性内皮细胞增生,基底膜缺血性皱缩,其中1个细胞性、2个小细胞纤维性新月体形成。肾小管萎缩,灶状代偿肥大。肾间质灶状淋巴及单核细胞浸润伴纤维化。小动脉管壁增厚,内膜葱皮样增生,管腔狭窄(图2)。诊断:系膜增生性IgA肾病伴恶性高血压肾损伤。

图2. 合并恶性高血压的IgA肾病:肾小球小叶间动脉管壁增厚,内膜葱皮状增生,管腔狭窄(HE×200)
结合临床及病理检查结果,患者IgA肾病继发恶性高血压肾损伤诊断明确,将短效血管紧张素转化酶抑制剂(ACEI)卡托普利改为长效依那普利30 mg/d,并继续予硝苯地平控释片60 mg/d、卡维地洛50 mg/d,血压控制在130/90 mmHg左右。关于原发肾小球疾病,患者肾小球缺血性硬化广泛,在肾活检标本中仅见5个未硬化的肾小球,其中1个细胞性、2个小细胞纤维性新月体,且在血压控制平稳后复查尿蛋白仍达3.1 g/d,血肌酐持续高,考虑有一定活动性病变。给予患者泼尼松40 mg/d、环磷酰胺50 mg/d。1个月后复查尿蛋白2.5 g/d,血肌酐390 μmol/L。泼尼松逐渐减量,6个月后停用。环磷酰胺4个月后停用(总量约6 g)。目前随访1年,监测血压130/80 mmHg左右,血钾水平正常范围,血肌酐350~400 μmol/L,尿蛋白1~2 g/d。
最终诊断:慢性肾小球肾炎(系膜增生性IgA肾病伴恶性高血压肾损伤);慢性肾脏病3期;肾性高血压
03/讨论
恶性高血压是一种高血压危象,中青年男性多见,常累及心、脑、肾等重要脏器。其诊断标准:①舒张压大于130 mmHg。②眼底检查可见视网膜水肿和火焰状出血、棉絮样渗出(Ⅲ级眼底病变)和(或)视盘水肿(Ⅳ级眼底病变)。恶性高血压可由原发或继发性高血压引起。继发性因素包括肾实质疾病、肾血管疾病、及内分泌疾病(如嗜铬细胞瘤、库欣综合征),其中肾实质疾病是最常见的原因之一,而IgA肾病是最常见的引起恶性高血压的肾实质疾病。合并恶性高血压的IgA肾病患者往往肾功能恶化迅速,如不及时控制血压,可很快进展至终末期肾脏病。
一些线索可帮助鉴别肾实质性恶性高血压和原发性恶性高血压:临床上,前者尿蛋白量较大(即使血压控制较平稳后),常可达肾病水平;后者尿蛋白量较少,在血压得到控制后平均1 g/d左右。前者多无家族史,而后者相反。病理上,前者小动脉洋葱皮样病变可不典型,肾小球病变弥漫、球性分布,有相应原发性肾小球病的特点(如在本例患者健存的肾小球中即可见到系膜弥漫增生,新月体形成,这符合IgA肾病病变多样的特点);后者小动脉常呈典型洋葱皮样病变,肾小球以急性缺血性病变为主,病变常为局灶、节段性分布。对于IgA肾病继发恶性高血压患者的研究发现:恶性高血压的血管病变与肾小球病变可以不平行,如轻度系膜增生性IgA肾病可伴发严重的血管病变和肾小管间质病变,应引起重视。
需要说明的是,恶性高血压属于血栓性微血管病的范畴,对于此类患者需要明确是否存在临床显性的血栓性微血管病。显微镜下破碎红细胞比例增高、网织红细胞计数升高、血小板减少及血乳酸脱氢酶升高提示可能存在机械性溶血,是支持血栓性微血管病的临床线索。此外,还需结合临床表现评价高血压的相关靶器官损害。
恶性高血压确诊后需积极降压治疗,以防止脑血管事件、急性肺水肿和肾衰竭等严重合并症的发生或进展。急性期可予静脉硝普钠静滴,长期控制血压以ACEI/血管紧张素受体激动剂(ARB)为基础,一般需两种或两种以上降压药物联合治疗。随着血压的降低肾小动脉纤维素样坏死的吸收,肾脏病理改变可以部分逆转,肾功能损害可能会终止或好转。部分进入透析的患者尚可脱离透析,但可能需观察数月。肾实质疾病继发恶性高血压者较原发恶性高血压者预后差。有学者认为血压是可干预的影响肾脏预后的危险因素。
本病例除降压治疗之外,还给予了激素和环磷酰胺的免疫抑制治疗。这是针对其原发肾小球疾病——IgA肾病的治疗,由于该患者活检标本健存的肾小球数量少,在仅有的5个健存肾小球中,仍能看到一些活动病变,考虑到IgA肾病病变不均匀的特点,不能排除其仍有较多活动病变,呈进展性;且患者较年轻,一般状态较好,可耐受免疫抑制治疗,因此,我们按照改善全球肾脏病预后组织(KDIGO)指南关于进展性IgA肾病的治疗建议,应用了激素和环磷酰胺。在临床上,使用激素和免疫抑制剂时,要结合个体情况,仔细权衡利弊,密切监测其可能带来的副作用。
参考文献
[1] Boulestreau R, et al. J Am Heart Assoc. 2022; 11(7): e023397.
[2] Lewek J, et al. Expert Opin Pharmacother. 2020;21(10):1189-1192.
[3] Haridasan S, et al. Indian J Nephrol. 2021;31(5):467-473.
[4] Jolobe O. Br J Hosp Med (Lond). 2015;76(3):177.
- 推荐文章
揭秘BAFF、APRIL在IgA肾病中的作用以及治疗研究进展
2a期IGNAZ研究最终结果:Felzartamab持续减少IgA肾病患者蛋白尿并减缓eGFR下降 | WCN 2025
患者小课堂|肾功能的好与坏,谁说了算?
远离腹膜透析的“隐形杀手”!肾病透析患者继发于牙龈感染后的反复发作性腹膜炎
常染色体显性多囊肾病中的肾切除术:ERA基因和肾脏工作组的共识声明
迄今为止最大横断面研究显示:适量至大量饮用啤酒以及适量饮用葡萄酒与肾结石患病率降低显著相关
WCN高影响力临床试验 | Ⅲ期REGENCY试验结果公布——奥妥珠单抗治疗活动性狼疮性肾炎显著有效且安全
多维度研究结合AI、多组学分析助力钙化防御研究获突破,中国两项成果亮相WCN 2025
WCN高影响力临床试验 | 探索CKD孕妇新疗法:甜菜根汁或成关键?
河南省人民医院肾内科团队2项成果亮相WCN 2025,泽贝妥单抗治疗特发性膜性肾病前景广阔
WCN高影响力临床试验 | FLOW试验中不同CKD严重程度下司美格鲁肽的临床与安全性结果公布
WCN中国之声 | 北大医院崔昭教授团队研究揭示抗nephrin抗体在中国成人MCD与原发性FSGS患者中的临床意义
WCN中国之声 | 北大研究团队发布中国2型糖尿病合并CKD患者10年用药“全景图”
WCN 2025 | 预测CKD进展的冰火两重天:TGF-β亚型遭否定,贝叶斯深度学习算法或成新宠
WCN2025 | 新型药物Sparsentan一线治疗IgA肾病取得关键进展,SPARTAN试验的中期成果发布
WCN中国之声 | 血管钙化与自噬基因揭示糖尿病肾病潜在致病机制
WCN2025 | 醛固酮合酶抑制剂联合SGLT2抑制剂协同增效,显著降低CKD患者尿蛋白
WCN中国之声 | 郑大一附院肾脏内科医学部研究团队开辟维持糖尿病患者钾稳态的新视角
WCN 2025本地组织工作组主席解读:印度首次举办WCN的里程碑意义与愿景
苏大附一院两项研究亮相WCN 2025,助力早期识别CKD和预测脓毒症相关AKI进展
WCN中国之声 | AI+视网膜血管几何参数——解放军总医院研究团队构建糖尿病肾病无创诊断及预后预测模型
ISN主席谈WCN 2025的作用——肾脏病学发展的关键引擎
WCN 2025 | 中国学者研究揭示肾结石与脂代谢紊乱的遗传关联
WCN中国之声 | 李贵森教授团队揭秘控制CKD血管钙化的新靶点和FSGS足细胞损伤新机制
WCN中国之声 | 培莫沙肽治疗NDD-CKD贫血不劣于阿法依泊汀,更优铁剂利用
WCN中国之声 | 整合前沿生物信息学技术确定AKI新治疗靶点——来自中国香港学者的三项研究
年度盘点 | 杨琼琼教授:肾性贫血治疗指南与研究进展
年度盘点丨以 “精准导航” 为翼,探秘脓毒症相关AKI诊断新境
WCN 2025 | 创新肾类器官模型,为肾毒性筛查提供新方法
APCN前主席:IgA肾病东西方临床特征差异与未来治疗展望
T2DM合并CKD的分层管理策略:英国ABCD-UKKA联合指南要点概述
从发病机制到诊疗指导:遗传学研究为ADPKD诊疗带来新视野
2025 KDIGO ADPKD临床实践指南重磅公布:妊娠和生殖、儿童相关话题及患者管理方法(完结)
2025 KDIGO ADPKD临床实践指南重磅公布:ADPKD的肾外表现评估与管理以及生活方式干预篇(未完待续)
2025 KDIGO ADPKD临床实践指南重磅公布:治疗药物及管理方法篇(未完待续)
利妥昔单抗治疗成人肾病综合征的研究进展
医路“肾”行,智“会”指南——2025年肾脏病领域学术会议全览
ICCN 2024速递:利用大数据指导急性肾损伤管理
CCSN 2024丨周晓霜教授:基于大数据的CKD全程管理与预测模型研究
CCSN 2024丨阳晓教授:腹膜透析治疗,发展与机会并存
CCSN 2024丨国际IgA肾病领军者专访:解读KDIGO指南更新,明晰IgA肾病管理新动向
CCSN 2024丨杨琼琼教授:从代谢视角探索心肾共治的新策略
“对因治疗”又添新证据——布地奈德肠溶胶囊靶向肠道、直击病因,抑制下游补体系统的激活,对全身免疫系统无影响丨ASN 2024
ASN 2024中国之声 | 南方医院秦献辉教授团队:高PURE评分与较低的CKD风险相关
ASN中国之声 | 肾病瘙痒领域再添新药,中国原研外周选择性κ阿片受体激动剂(HSK21542)Ⅲ期结果首次公布!
Kidney Week 2024 | 10月27日,今日聚焦:全体会议ASN中期职业生涯奖颁奖,激励英才展望未来
ASN 2024丨真实世界数据提示IgA肾病患者早诊、早治、早获益!
CCSN 2024丨罗朋立教授:腹透相关性感染性腹膜炎对心血管不良事件的影响及防治策略
CCSN 2024丨中外大咖齐聚中华肾年会,共同绘制IgA肾病治疗新蓝图
CCSN 2024丨徐钢教授:细胞外囊泡递药系统在肾脏病中的应用探索
CCSN 2024丨周晓玲教授:肿瘤免疫治疗相关肾损害的机制、流行病学及应对策略
CCSN 2024丨刘军教授:单克隆免疫球蛋白相关肾损害(MGRS)的诊断思路和方法
CCSN 2024丨涂晓文教授:脓毒症相关急性肾损伤CRRT启动时机的探讨
关节痛也会导致肾受伤吗?自身免疫性疾病之类风湿性关节炎与肾脏的“亲密”关系
李贵森教授:全面梳理IgAN的治疗进展
