摘要:IgA肾病是全球最常见的原发性肾小球肾炎,其发病与半乳糖缺陷型IgA1(Gd-IgA1)的产生、免疫复合物的形成并沉积于肾小球系膜区密切有关,B细胞活化因子(BAFF)和增殖诱导配体(APRIL)作为Gd-IgA1及其自身抗体产生的关键调节因子,在B细胞活化以及体液免疫过程中发挥重要作用。临床研究显示,IgA肾病患者血清中BAFF和APRIL水平升高与疾病严重程度存在关联,抑制这两种因子有望成为治疗IgA肾病的全新策略。部分相关药物在临床试验中展现出一定疗效和安全性。本文对IgA肾病发病机制进行综述,重点探讨了BAFF和APRIL在其中的关键作用,并介绍了针对它们的靶向治疗及临床研究进展。
一、IgA肾病的临床管理现状
IgA肾病是全球范围内经活检证实的最常见原发性肾小球肾炎。由于医疗资源可及性、数据采集质量、筛查实践以及肾活检阈值存在差异,其确切患病率难以精准确定,并且在不同地区和种族间呈现出显著的地理差异与种族差异,遗传因素在其中起着重要作用。在北美地区,IgA 肾病约占活检证实的原发性肾小球肾炎病例的10%~20%;在欧洲,这一比例为20%~30%;而在东亚地区,该比例高达40%`50%。
鉴于IgA肾病的复杂性以及预后的不确定性,个性化治疗对于实现 IgA 肾病的最佳管理至关重要。尽管在探索IgA肾病发病机制方面已取得较大进展,但目前仍缺乏能够选择性影响 Gd-IgA1 和(或)相关自身抗体合成的疾病修饰治疗手段。
2024版KDIGO IgA肾病指南公开审查版提出,对于蛋白尿大于0.5 g/d的IgA肾病患者,应积极启动对因治疗和对症治疗。布地奈德肠溶胶囊(Nefecon)是目前唯一可用的对因治疗药物,可以减少致病性IgA1的产生,与此同时可以使用补体抑制剂管理肾小球炎症。对症治疗药物包括使用血管紧张素转换酶(ACE)抑制剂或血管紧张素受体阻滞剂(ARB)阻断肾素-血管紧张素系统(RAS)、内皮素A和血管紧张素II?双重受体拮抗剂司帕生坦(sparsentan)和钠-葡萄糖协同转运蛋白-2抑制剂(SGLT2i),同时需综合管理心血管风险因素,包括严格控制血压、减少饮食钠摄入、戒烟、治疗高脂血症、控制体重和规律运动。此外,目前还有20多种针对B细胞产生Gd-IgA1、补体激活及IgA沉积后下游通路的药物处于临床研发阶段。需要提醒的是,糖皮质激素在IgA肾病治疗中的应用存在争议,其最佳剂量、疗程和适用患者群体尚不明确。
二、IgA肾病的发病机制与“四重打击假说”
IgA肾病的核心发病机制是循环中半乳糖缺陷型IgA1(Gd-IgA1)水平升高。正常情况下,IgA1的铰链区在糖基转移酶作用下进行糖基化修饰,添加含N-乙酰半乳糖胺(GalNAc)和末端半乳糖残基的O-聚糖。而在IgA肾病患者中,铰链区缺乏半乳糖残基的IgA1(Gd -IgA1)增多,使GalNAc残基暴露,可被易感个体的抗聚糖自身抗体识别,形成循环免疫复合物。这些免疫复合物对系膜细胞具有较高的亲和力,沉积于系膜区后会引发一系列炎症反应(图1)。
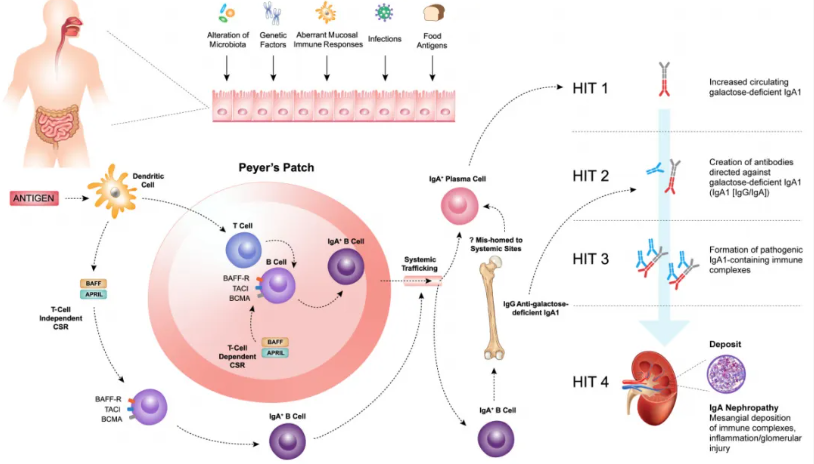
图1. IgA肾病“四重打击”学说
多项证据表明,IgA肾病患者循环中增加的Gd-IgA1主要来源于黏膜。人体大部分IgA由黏膜相关淋巴组织(MALT)中的浆细胞产生,其中肠道相关淋巴组织(GALT)和鼻咽相关淋巴组织(NALT)在IgA肾病发病中起重要作用。在MALT中,抗原被抗原呈递细胞(如树突状细胞)摄取,激活初始B细胞并诱导其发生类别转换重组(CSR)形成IgA+B细胞,此过程需T细胞依赖(TD)或T细胞非依赖(TID)的共刺激信号。正常黏膜免疫中,IgA转换对维持黏膜稳态至关重要,但在IgA肾病中,B细胞活化和CSR异常导致Gd-IgA1产生增加。
BAFF和APRIL属于肿瘤坏死因子(TNF)超家族,在TD和TID CSR以及IgA+B细胞产生过程中发挥关键作用。它们与B细胞成熟抗原(BCMA)和跨膜激活剂及钙调亲环素配体(TACI)这两种受体结合(图2)。BCMA主要在浆细胞上表达,TACI在成熟B细胞和活化浆细胞上均有表达,BAFF还可与特异性的BAFF受体(BAFF-R)结合。BAFF-R主要表达于B细胞,在人系膜细胞和肾小管上皮细胞(TECs)上也有表达,并且BAFF可上调人TECs中BAFF-R的表达,从而形成自分泌环路。
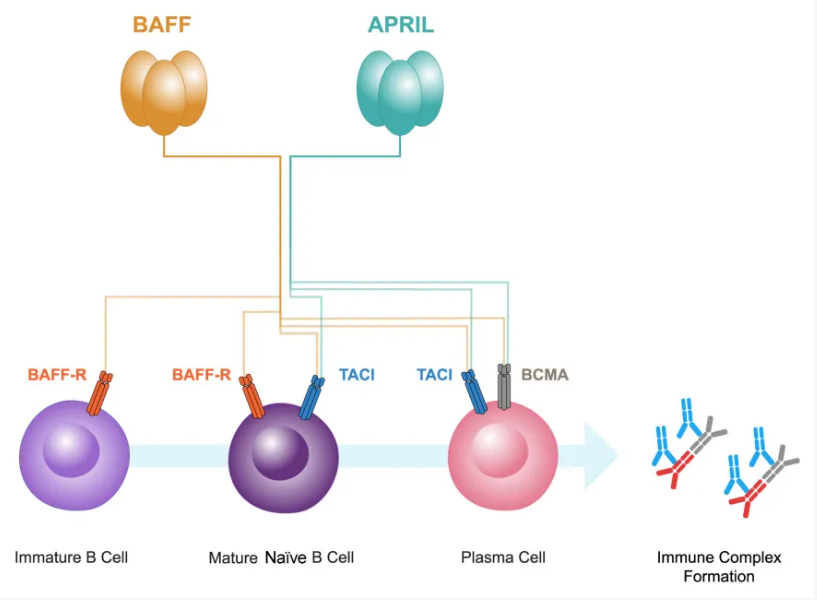
图2. BAFF和APRIL与受体结合
在IgA肾病患者中,可能存在黏膜来源的IgA浆细胞错误迁移至全身部位(如骨髓),导致循环中产生“黏膜型” Gd-IgA1。也有研究提示Gd-IgA1可能通过肠腔逆向转运或IgA+B细胞向肾脏的异常迁移参与发病。仅有Gd-IgA1水平升高并不足以引发IgA肾病,其发病还需形成包含Gd-IgA1的免疫复合物,这构成了IgA肾病“四重打击假说”的基础。该假说认为,循环中Gd-IgA1水平升高(第一击)诱导IgA和IgG自身抗体产生(第二击),二者形成免疫复合物(第三击),并沉积于肾小球系膜区并引发肾脏损伤(第四击),因此IgA肾病被视为一种自身免疫性疾病。系膜细胞活化、补体系统激活及细胞因子和趋化因子释放,会导致局部炎症和纤维化,进而造成肾小球损伤、滤过屏障破坏,最终出现血尿、蛋白尿和进行性肾功能障碍等典型症状。
三、靶向B细胞治疗IgA肾病
在IgA肾病中,B细胞负责产生循环免疫复合物的关键成分——Gd-IgA1和IgG/IgA抗聚糖自身抗体。而BAFF和APRIL作为影响B细胞活性的关键因素,通过与特定B细胞受体结合,成为影响IgA、Gd-IgA1和免疫复合物形成的重要治疗靶点。
BAFF对B细胞成熟至关重要,在维持外周B细胞的激活、存活和分化中发挥关键作用,其与主要受体BAFF-R的相互作用是维持B细胞稳态的关键环节。微生物抗原可通过与抗原呈递细胞表面的模式识别受体(如Toll-like受体)结合,诱导BAFF和APRIL释放,从而将固有免疫和适应性免疫应答连接起来。BAFF和APRIL进而激活B细胞,促进IgA CSR和B细胞存活,支持B细胞分化为长寿命浆细胞。这些浆细胞可在骨髓、次级淋巴器官和黏膜部位等生存微环境中持续产生抗体,其中包括Gd-IgA1,这可能导致IgA肾病中Gd-IgA1和抗Gd-IgA1自身抗体的持续产生。
APRIL同样对B细胞的存活和分化至关重要,可通过其受体影响B细胞向浆细胞分化,并刺激B细胞产生IgA。在黏膜环境中,APRIL能诱导初始B细胞向IgA产生细胞发生类别转换。体外研究表明,APRIL刺激IgA肾病患者的B细胞可使Gd-IgA1产生增加,这提示了APRIL在促进IgA1异常糖基化方面具有直接作用。
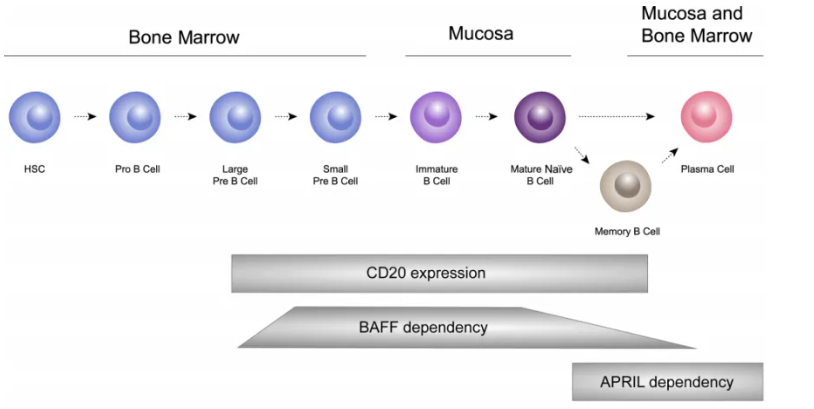
图3. B细胞成熟过程及其BAFF和APRIL在其中的作用
四、BAFF和APRIL在IgA肾病中的临床证据
(一)BAFF在IgA肾病中的临床证据
多项研究表明,IgA肾病患者血清BAFF水平较健康对照显著升高,且与IgA1水平呈正相关。在组织学和临床上,BAFF水平与疾病严重程度均密切相关,如与系膜IgA沉积密度、系膜细胞增生、节段性肾小球硬化及间质纤维化/肾小管萎缩均有关系,同时还与患者肾功能减退(eGFR降低和血清肌酐升高)相关。此外,IgA肾病患者扁桃体单核细胞受刺激后,BAFF和IgA表达水平较非IgA肾病者明显增加。
在一项名为BRIGHT-SC(NCT02062684)的I/II期研究中,评估了BAFF选择性抑制剂Blisibimod在IgA肾病患者中的疗效和安全性。初步结果显示,Blisibimod组的B细胞亚群和Ig水平显著降低,表明其对BAFF有药理抑制作用。该组患者的蛋白尿水平保持稳定,而安慰剂组则明显恶化。
(二)APRIL在IgA肾病中的临床证据
基因多态性研究显示,编码 APRIL(TNFSF13)和TACI受体(TNFRSF13B)的基因多态性与IgA肾病易感性相关。IgA肾病患者血清APRIL水平升高,且与疾病严重程度及Gd-IgA1表达增加相关。高水平的APRIL还与不良预后相关。因此,抑制APRIL的治疗策略有可能限制IgA,从而,进而限制自身免疫相关浆细胞产生Gd-IgA1。
抗APRIL抗体VIS649(Sibeprenlimab)在健康志愿者和IgA肾病患者中均进行了研究。在健康志愿者中,治疗后血清游离APRIL水平受到抑制,血清Gd -IgA1、IgA、IgM水平降低,BAFF水平变化较小。在一项纳入155例IgA肾病患者的II期研究中,患者随机接受每月静脉注射(IV)2、4 或 8 mg/kg 的Sibeprenlimab或安慰剂治疗12个月。结果显示sibeprenlimab治疗组患者的Gd-IgA1和IgA水平降低,蛋白尿显著减少,24小时尿蛋白/肌酐比值(UPCR)在12个月时分别降低 47.2%、58.8%和62.0%(2、4、8 mg/kg IV 剂量组),而安慰剂组降低20.0%;12个月时eGFR变化分别为-2.7、+0.2 和-1.5 mL/min/1.73m2(Sibeprenlimab 2、4、8 mg/kg 组),安慰剂组为-7.4 mL/min/1.73m2,这表明Sibeprenlimab可减缓肾功能下降,且未出现明显的安全问题。目前,Sibeprenlimab治疗IgA肾病的III期试验VISIONARY正在进行中。
另一项评估抗APRIL单克隆抗体BION-1301(Zigakibart)在IgA肾病患者中的I/II期开放标签单臂研究的中期结果显示,患者Gd-IgA1、IgA水平持续降低,IgG水平也有一定程度降低,同时蛋白尿减少,该药物目前也在开展全球III期临床试验BEYOND。
五、BAFF和APRIL在IgA肾病中的双重抑制作用及相关药物研究
BAFF和APRIL在B细胞稳态和功能中均起关键作用。在IgA肾病中,二者及其信号通路的失调通过影响B细胞和浆细胞功能,促进IgA和抗聚糖自身抗体产生、免疫复合物形成及在肾脏的沉积,从而参与疾病发病。BAFF主要参与B细胞的存活和成熟过程,支持过渡型和成熟B细胞的存活,对于B细胞向免疫球蛋白产生细胞的分化及后续存活至关重要;而APRIL在B细胞分化的后期阶段作用更为突出,对长寿命浆细胞和其他B细胞亚群的存活也非常关键,尤其在骨髓和MALT等产生抗体的部位意义显著。
鉴于BAFF和APRIL的重要作用,靶向它们的双重抑制策略为IgA肾病治疗提供了新方向。阿塞西普(Atacicept)能够结合可溶性BAFF和APRIL以及膜结合BAFF,干扰细胞因子与受体的相互作用。2b期ORIGIN研究纳入了116例IgA肾病患者,结果显示,24周时,与安慰剂组相比,Atacicept 150 mg 和75 mg联合组的平均UPCR较基线降低31%(安慰剂组降低 7%,p=0.037),Atacicept 150mg组在24周时蛋白尿较基线降低33%,且在36周时,该组平均UPCR较基线降低33%,与安慰剂组相比降低35%(p=0.012)。在eGFR方面,Atacicept 150 mg组较基线增加1.6%,而安慰剂组降低8.5%,差异显著(p=0.038)。在36周时,Atacicept 150 mg组的Gd-IgA1水平较基线降低64%(p<0.0001)。在安全性方面,Atacicept耐受性良好,感染率与安慰剂组无差异,严重不良事件总体发生率低,且未出现因低丙种球蛋白血症导致的停药或中断情况。
六、结论
综上所述,BAFF和APRIL在IgA肾病的免疫系统调节中,尤其是在IgA肾病的免疫失调过程中,具有关键作用。早期针对抑制这些细胞因子的安全性和有效性研究为IgA肾病治疗开辟了新途径,临床试验结果也支持针对BAFF和APRIL靶点的策略在IgA肾病治疗中的潜在益处。然而,目前仍需更多大规模、长期的Ⅲ期临床研究来进一步明确这种治疗方法在保护肾功能、预防肾衰竭方面的长期疗效和安全性,从而为IgA肾病患者提供更为有效的治疗方案,改善其预后和生活质量。
参考文献:Cheung CK, et al. Front Nephrol . 2024; 3: 1346769. doi: 10.3389/fneph.2023.1346769.



